




| 简体中文 | ||
| 同义词 | 无 | None |
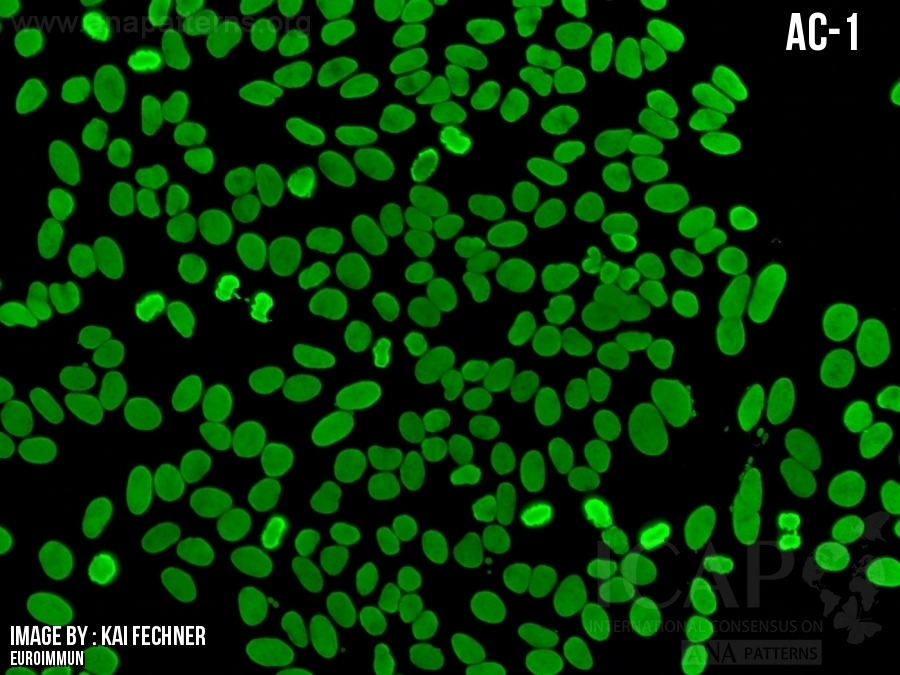
| 描述 | 这些图像是ANA阴性(显微镜下观察)的示例。由于ANA阴性图像会有不同的呈现形式,所以AC-0不能当做绝对的ANA 阴性,只是作为一个对照。为什么会有这么多种可能的变化是由于目前缺乏明确的细胞内结构染色标准,且比较主观并只能做到半定量。我们需要讨论的是如何确定区分ANA阳性和ANA阴性的临界值。目前,普遍的共识认为这个临界值应该通过对部分正常对照人群的实验数据来确定。同时,临界值的确定高度依赖于不同实验室所使用的HEp-2基质,包括因不同制造商和不同批次来源的HEp-2载片本身的差异、荧光染料偶联的二抗试剂、显微镜和相机的设置、血清稀释度以及其他变量。在使用电脑屏幕在线读取AC-0图像时,应注意不同的电脑默认的屏幕亮度设置也是不同的,可能需要做一些调整从而到正确的解读。对于有两个屏幕的电脑来说,其屏幕的亮度也不一定是同步的。这些AC-0的图片用于展示一些细胞的清晰度,包括分裂中期的细胞,如果不能看到足够的细节,则可能是屏幕亮度设置太暗;另一方面,如果这些图片的绿色荧光较强,请考虑是否屏幕亮度设置得太亮。总之,在电脑屏幕上读取这些图像时应该根据情况相应地调整屏幕的亮度设置。值得注意的是,当使用PC/MAC电脑下载并读取这些AC-0图像时,除了上述屏幕亮度设置之外,根据不同的图像读取软件可能还会出现一些其它的变化。 见Herold等人著作查看完整讨论 (Clin Chem Lab Med. 2018;56:1799-802.) Herold M, Klotz W, Andrade LEC, Conrad K, de Melo Cruvinel W, Damoiseaux J, Fritzler MJ, von Muhlen CA, Satoh M, Chan EKL. International Consensus on Antinuclear Antibody Patterns: defining negative results and reporting unidentified patterns. Clin Chem Lab Med. 2018;56:1799-802. |
These images are provided as examples of what are considered as ANA-negative as viewed under a microscope. Since a negative ANA can be represented by a number of different images, it should be clear that AC-0 should not be regarded as the definite example but used for comparison purposes only. The guiding feature that links these variable possibilities is the absence of a clear-cut staining in any given subcellular structure. This definition is both subjective and semi-quantitative at best. There should be a discussion regarding how ANA-positive vs ANA-negative cut-off is determined. There are general consensus that such cut-offs should be determined experimentally and locally with normal population controls. The cut-off is highly dependent on the HEp-2 substrates used by individual laboratories, including factors specific to HEp-2 slide manufacturers and lot-to-lot variations, fluorochrome conjugated secondary antibody reagents, microscope and camera settings, serum dilutions, and other variables. In viewing these AC-0 images online using a computer screen, note that the screen default brightness setting may vary from computer to computer and some adjustment may be necessary for appropriate interpretation. For computer with two screens, the brightness for both screen is not necessary in sync either. These AC-0 images are selected to show some definition of cells, including cells in metaphase. If one cannot see sufficient details, probably the screen brightness is set too dark. On the other hand, if these images show too much green staining, please consider the screen brightness is set too bright. In summary, viewers of these images on computer screen should make appropriate adjustment in their screen brightness setting accordingly. Please note that when these AC-0 images are downloaded and viewing with PC/Mac computers, there may be additional variations depending on the image viewing software, in addition to screen brightness setting as discussed above. See Herold et al. for full discussion (Clin Chem Lab Med. 2018;56:1799-802.) Herold M, Klotz W, Andrade LEC, Conrad K, de Melo Cruvinel W, Damoiseaux J, Fritzler MJ, von Muhlen CA, Satoh M, Chan EKL. International Consensus on Antinuclear Antibody Patterns: defining negative results and reporting unidentified patterns. Clin Chem Lab Med. 2018;56:1799-802. |
| 抗原相关性 | 不适用 | Not applicable |
-
无无
-
一级信息参考文献First level information references
-
无无
-
二级信息Second level information
-
无无
-
二级信息参考文献Second level information references
-
无无
FAQ
-
HEp-2 IFA中Ro/SS-A和La/SS-B呈阴性。如果在我ANA IFA阴性测到靶抗原Ro和La存在,该如何解释?
HEp-2免疫荧光法(IFA)染色可能有一些显著的差异,这取决于HEp-2细胞载玻片的制造商。一些自身抗原和表位在某些细胞制剂中可能不可用。为了确保所使用的HEp-2载玻片能够检测抗ro60 /SS-A和抗la /SS-B染色,应使用合适的参考材料,如www.AutoAb.org的参考品来验证HEp-2载玻片和实验中使用的其他试剂。该领域的专家还建议使用低滴度阳性对照来测试每批HEp-2载玻片,以获得适当的灵敏度。如果明确定义的抗ro60 /SSA和抗la /SS-B标准没有显示核染色,这清楚地表明IFA尚未针对这些自身抗原进行优化。特别是Ro60自身抗原,似乎是不稳定的,可以用温和的溶剂提取和长时间暴露于一些缓冲液中。
Anti-La/SS-B -一般来说,通过固相测定(SPA)确定的高滴度阳性Anti-La/SS-B血清在HEp-2 IFA中很大可能呈阳性。高滴度抗la /SS-B血清不太可能在HEp-2细胞染色中呈阴性。需要注意的是,单特异性抗la /SS-B血清非常罕见,因此IFA阳性染色都可能与第二抗体有关如抗ro60 /SS-A。
Anti-Ro60/SS-A -有报道称SPA阳性的Anti-Ro60/SS-A血清可能HEp-2 IFA阴性。Anti-Ro60/SS-A通常呈AC-4核斑点染色,但在某些市售HEp-2载玻片中,Anti-Ro60/SS-A可能呈阴性。一家生产商提供高表达Ro60/SS-A抗原的HEp-2细胞载玻片,据报道,这种底物比传统HEp-2底物检测这种抗体具有更高的敏感性和特异性。相反,Ro52 (TRIM21)自身抗体在HEp-2 IFA试验中不能被常规识别。因此,单特异性抗ro52 /TRIM21血清HEp-2 IFA可能完全阴性。
日期:2019年03月07日
-
单纯细胞质阳性是ANA阳性还是阴性? 你好,如果你能告诉我如何报告细胞质染色(没有核染色)为ANA阳性或阴性,我将不胜感激。
这是ICAP委员会广泛讨论的问题,但迄今尚未达成共识。在许多国家,仅显示细胞质染色的血清被认为是ANA检测阳性,而在其他国家,这类血清被认为是ANA阴性但细胞质阳性。在其他一下区域,细胞质染色根本没有报道,因为它不能严格定义为核染色。人们普遍认为,单独进行细胞质染色的血清不应被忽视(1)。关于该主题的其他讨论建议将ANA测试重命名为抗细胞抗体(1),这与ICAP为各种荧光模式(即AC =抗细胞)选择的命名法一致。如何报道这种情况是一个本地问题。然而,是否确定为ANA阳性或阴性对某些疾病分类标准有影响。ICAP正努力在未来一年达成共识。
N. Agmon-Levin, J. Damoiseaux, C. Kallenberg, U. Sack, T. Witte, M. Herold, X. Bossuyt, L. Musset, R. Cervera, A. Plaza- Lopez, C. Dias, Sousa M. Jose, A. Radice, C. Eriksson, O. Hultgren, M. Viander, M. Khamashta, S. Regenass, L. E. Coelho Andrade, A. Wiik, A. Tincani, J. Ronnelid, D. B. Bloch, M. J. Fritzler, E. K. Chan, I. Garcia-de la Torre, K. N. Konstantinov, R. Lahita, M. Wilson, O. Vainio, N. Fabien, R. A. Sinico, P. Meroni, and Y. Shoenfeld. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann.Rheum.Dis. 73:17-23, 2014.
日期:2019年03月14日
-
双重免疫荧光是一种能够帮助去识别出比如像核仁的亚细胞结构的一种双重荧光标记方法。
许多典型的HEp-2试剂盒都带有异硫氰酸荧光素(FITC)偶联物,如山羊抗人IgG。对于双免疫荧光IFA方法,您需要配备适合多色成像的激发器和波谱滤光片的荧光显微镜。此外,需要针对您感兴趣的亚细胞结构特异性蛋白质的单克隆或多克隆抗体。这种动物抗体将成为亚细胞结构域的示踪剂。如果我们以核仁为例,那么你需要一种针对核仁蛋白的抗体(例如,纤维蛋白,核仁磷酸化蛋白B23等)。假设你可以获得市售的小鼠单克隆抗纤维蛋白IgG抗体。普遍的做法是用红色荧光染料(例如罗丹明或Alexa586)偶联的山羊抗小鼠IgG,以将其与FITC染色的人抗核仁抗体区分开来。并且重要的是针对小鼠IgG的荧光染料与FITC不同,并且需要与用于FITC的激发/发射/阻挡滤光光谱中的光信号不重叠。在这个过程中,建议先用单克隆抗体稀释度优化反应,能够保证两者的稀释度都应能产生良好的荧光信号。同一个HEp-2反应体系中,你将培养人类抗体和小鼠单克隆抗纤维蛋白抗体。
对于双重荧光免疫方案,一抗孵育步骤有三种选择:
1)人抗体孵育==> 清洗(不要让细胞基质干)==> 应用小鼠单克隆孵育==> 清洗==> 加入将两种按适当的稀释度和比例混合后偶联二抗==> 清洗==> 滴入介质(如缓冲甘油)和盖片。
2)鼠单抗孵育==> 清洗(不要让细胞基质干)==> 应用人抗体孵育==> 清洗==> 加入将两种按适当的稀释度和比例混合后偶联二抗==> 清洗==> 滴入介质(如缓冲甘油)和盖片。
3)混合小鼠单克隆抗体和人抗体,需考虑到两者的稀释度现在减少了一半==> 清洗==> 加入将两种按适当的稀释度和比例混合后偶联二抗==> 清洗==> 滴入介质(如缓冲甘油)和盖片。
在一些方案中,通常使用DAPI(蓝色染色)进行衬染是有帮助的,可能对于以上3个选项中的可能重要,也可能不重要。可能其中一种比另一种效果更好,这取决于你将使用的特定抗体。如果一种方法不起作用,尝试其他的两个方法。
然后,您将能够在同一个视野下看到每个荧光基团,你就可以分辨人抗体是否与单克隆抗体染色相同的亚细胞结构域。这对于拍摄相同视场下的高分辨率照片,然后根据需要使用Adobe PhotoShop等图像处理程序将图像重叠,显然是一个优势。
日期:2019年03月23日
-
紫外线光强增加的问题。当紫外线光强增加时,ANA阴性样本可能会变为可见或阳性。如何处理这类问题?
在HEp-2间接免疫荧光检测法(HEp-2 IFA)中,需要非常注意紫外光强度对ANA阳性的影响,现代紫外线光源通过简单设置即可实现紫外光强增加,较旧的显微镜则通常需要更换灯泡。而如本问题所示,任何光源强度的增加都会影响对HEp-2 IFA阳性的判读。另外HEp-2 IFA推荐的放大倍数为x400(x40物镜),放大倍数偏低会导致低强度阳性样本被判为阴性。
为确保光源设置合适,每个实验室都应有一套阳性和阴性的人血清样本作对照。在此简要讨论关于阴性HEp-2 IFA样本的选择:应使用特定试剂及显微镜设置,确定当地人群中HEp-2 IFA的cut-off。临床实验室应具有包括从几乎完全阴性到临界阳性的HEp-2 IFA阴性血清,而后者也许最适合作为设置光强度的参考控制品 。此外还需考虑荧光二抗,鉴于显微镜设置差异,HEp-2载片试剂中提供的即用型二抗并不能适用于所有客户,因此以已知的阴性和低强度阳性样品确定二抗浓度是较为明智的选择。
日期:2019年06月08日
-
HEp-2 IFA结果与蛋白质印迹法结果存在差异。应当如何解释通过蛋白质印迹 (WB) 检测到的抗体与通过间接免疫荧光 (IFA) 在 HEp-2 细胞中检测到的染色模式无关?
这并非一类罕见的现象,对于这种明显的差异有几种可能的解释。
人们认识到每个免疫测定方法学(IFA、WB、ELISA、免疫沉淀 (IP) 等)都依赖于与自身抗原相关的一组特定表位 (1)。广义上,自身抗体能识别线性和/或不连续(天然或构象)表位。在不连续表位的背景下,重要的是要认识到许多自身靶抗原是大分子复合物的一部分,其中独特的表位可能为四级结构。表位结构得到最好保存的免疫测定方法学包括细胞裂解物的免疫沉淀和 HEp-2 IFA。然而,HEp-2 IFA有一条重要的附加说明,由于细胞已固定在甲醇和/或丙酮(或其他非公开的商业机密类的固定剂)中,可能会改变一些表位并暴露其他表位。至于天然表位保存的问题,蛋白印迹存在最大的挑战,因为在变性条件下煮沸蛋白质的做法很可能会显著改变表位。当然有些蛋白质在将电荷转移到硝酸纤维素膜后可能会复性/重折叠,但更多蛋白质不会出现复性/重折叠。当印迹法所检测的抗体与在HEp-2 IFA中观察到的染色模式无关时,一种解释是IFA中识别的抗体表位与印迹法中识别的表位不同或仅代表一部分(甚至不同的表位)。抗原纤维蛋白抗体是其中一个例子; IFA 通常显示 AC-9 模式,但免疫印迹结果呈阴性,因为大部分的抗原纤维蛋白抗体在免疫印迹中不能识别变性的原纤维蛋白。
血清样本(尤其是SLE患者的样本)通常具有不止一种自身抗体特异性。因此,另一种解释是,当两种(或更多种)完全不同的抗体特异性共存于同一血清中时,尤其是在 HEp-2 IFA 上可能会观察到令人困惑的结果。在这种情况下HEp-2 IFA可以反映所有存在的自身抗体的IFA反应性的组合,并且如果血清中只有一种自身抗体特异性,则得到的染色模式可能与预期的染色模式不同。
1. Mahler M, Bluthner M, Pollard KM. Advances in B-cell epitope analysis of autoantigens in connective tissue diseases. Clin Immunol. 2003 May;107:65-79.
日期:2020年08月14日
-
IFA模式从核粗颗粒型转变为均质型; 问:一名患者的 HEp-2 IFA染色模式在 6 个月后从核粗颗粒型转变为均质型。这种情况可能发生吗?
答:在所有条件相同的情况下,使用同一生产厂商生产的同批次荧光载片、使用相同的酶结合物和相同的血清稀释度,并确保不存在操作上的技术问题,HEp-2 IFA染色模式可能会随着时间的推移而改变。这可能包括从阴性 (AC-0) 到任何AC编号荧光染色模式的变化,反之亦然。例如疾病进展或重叠综合征、新干预措施(药物、生物制品)、新暴露(传染病、癌症等)等在内的诸多因素都会导致此类变化。了解终点稀释度是否也发生变化(提升或降低至少2个梯度)是非常重要的。
在SLE病程中导致HEp-2 IFA结果变化因素的免疫学基础是什么?自身抗体水平确实会随着病程而波动。其中一些(例如,天然 DNA 和核小体)抗体可能随疾病活动度变化而波动,而另一些(即抗 Ro60 和抗 Sm)抗体的波动似乎独立于疾病活动度。
HEp-2 IFA随时间变化是否与疾病活动相关呢?大多数人都会认为不是,但答案并非这么简单。Andrade 实验室最近的一项研究从横向(活动期x缓解期x非活动期)和前瞻(同一患者在 1 年随访期间疾病活动度的变化)角度评估了 269 名 SLE 患者的 HEp-2 IFA 滴度和染色模式(1)。研究报告显示,染色模式和滴度变化可能会发生变化,并且与疾病活动状态存在一定关联。高滴度和 AC-1 染色模式与活动期疾病相关,而低滴度和 AC-4染色模式与疾病缓解期相关。
有趣的是,HEp-2滴度用于定义疾病活动性的诊断性能(ROC曲线AUC值)处于传统疾病活动度生物标志物(抗dsDNA、抗核小体抗体)的范围内,并且远高于C3和C4。然而,仍不建议将 HEp-2 IFA作为监测 SLE 疾病活动度的检测。相似的结论同样适用于其他与 ANA 相关的风湿性疾病。
因此,回到最初的病例,从 AC-5到 AC-1的变化可能表明抗核小体和/或抗 dsDNA 抗体的出现。建议留意这些自身抗体和可能爆发的疾病。
1. Prado MS, Dellavance A, Rodrigues SH, Marvulle V, Andrade LEC (2020) Changes in the result of antinuclear antibody immunofluorescence assay on HEp-2 cells reflect disease activity status in systemic lupus erythematosus. Clin Chem Lab Med 58:1271-1281. DOI: 10.1515/cclm-2019-0638
日期:2021年10月11日
-
HEp-2 IFA检测低滴度抗dsDNA血清呈阴性? 问:在1:20稀释度下使用绿蝇短膜虫检测呈dsDNA阳性的样本使用HEp-2 IFA检测是否会得到阴性结果?通过不同厂牌的商品化试剂确认了HEp-2 IFA为阴性。
答:在大多数情况下,含有抗 dsDNA 抗体的样本与核均质型 (AC-1) 相关。在极少数情况下无法观察到细胞核染色,因为样本所含抗体能识别的DNA表位存在于高度浓缩的绿蝇短膜虫动基体DNA中,但不存在于常用的商品化HEp-2细胞中。在这种情况下,使用另一个厂牌的 HEp-2 试剂盒进行 HEp-2 IFA的结果验证可能会有所帮助,结果可能为阳性,也可能仍为阴性。就您的情况而言,很明显您已经确认了不同商品化试剂盒都为阴性结果。在某些情况下,DNA与细胞核中的组蛋白和其他蛋白质(例如高迁移率族蛋白)相互作用而隐藏了抗 dsDNA 抗体靶向的DNA表位。在这种情况下,在 IF 实验之前用 0.1N HCl 提取组蛋白和其他核蛋白可能会使抗 dsDNA 抗体正常反应产生预期的AC-1荧光模式。最后,您需要确认您在绿蝇短膜虫为底物检测抗dsDNA抗体时观察到的免疫荧光反应对应于动质体而不是鞭毛基体。日期:2021年10月14日
-
多重、混合和复合HEp-2 IFA荧光核型的区别?问:您能提供更多关于ICAP如何定义HEp-2 IFA中多重、混合和复合荧光核型之间的差异的信息吗?
答:当我们观察到明确的单个的HEp-2 IFA荧光核型时,我们指的是单一核型,例如AC-23或AC-3。术语多重、混合和复合IFA荧光核型指的是多于单一核型但不同的概念。
1. 术语“多重荧光核型”适用于在单个血清样本中观察到两种或两种以上个体和明确可识别的荧光核型的情况,例如AC-1 + AC-23或AC-4 + AC-22(即,每种荧光核型都被清楚识别)。
2. 术语“混合荧光核型”适用于血清样本在同一细胞区域中产生多种模式并且不可能清楚地识别每种成分的观察。例如,AC-4 + AC-5通常可以一起看到,但我们无法区分每个组件(AC-4和AC-5);在这些病例中,HEp-2 IFA染色荧光核型被认为是混合核斑点荧光核型。
3.最后,术语“复合荧光核型”适用于单个抗体引起两个或多个细胞区域染色的情况,并且复合图形具此特征,以至于它总是引起该自身抗体的存在。例如,AC-26荧光核型是伴随有丝分裂纺锤体纤维染色的间期核染色荧光核型,通常与抗NuMA抗体相关。同样,AC-14模式,通常与抗CENP- F抗体相关,其特征是在间期细胞中具有可变强度的核细斑点染色,仅在有丝分裂细胞中具有精细的着丝粒染色,细胞间桥染色,而在前期细胞中仅具有核包膜染色。
日期:2021年11月18日
-
确定HEp-2 IFA的荧光核型所需的放大倍数是多少? 问:ICAP是否明确说明了HEp-2 IFA染色荧光核型在确定荧光核型之前应该评估的放大倍数?
答:在文献中,人们普遍认为,直接通过显微镜阅片时,准确评估HEp-2细胞上的IFA荧光核型需要至少400倍的总放大倍数(40倍物镜和10倍目镜)。但是,ICAP执行委员会没有作出类似的声明。
很多半自动IFA阅读器使用200倍的放大倍数,这足以解释许多荧光核型。然而,在半自动仪器(或传统显微镜)上拍摄的数字图像与通过显微镜目镜观看的实时图像不同。对于提交给ICAP的图像,建议最小放大倍数为400x。
为了更好全面地观察AC-29的5个特征(topo I-like)和AC-4a的核微小斑点,建议使用400倍的放大倍数。此外,在大多数情况下,还需要400倍的放大倍率来区分核仁荧光核型(AC-8、9、10)和核膜荧光核型(AC-11、12)。
日期:2021年11月18日